Article /
L’INFÉRENCE CAUSALE EN SANTE ORALE
Philippe Bouchard : Université de Paris Cité, U.F.R. d’odontologie, INSERM UMR 1333 Santé Orale, France.
Maria Clotilde Carra : Department of Translational Medicine, Université de Ferrarra, Italie.
Note : Les données de cet article sont celles au moment où celui-ci a été adressé au 25/09/2024.
Récemment, j’étais en vacances avec mon petit-fils et à chaque décision que je prenais, il me demandait : « pourquoi » ? Cette façon, un peu agaçante il faut bien l’avouer, de poser sans cesse la même question est la manière pour un enfant de procéder à la découverte de son environnement. Au vrai, s’interroger sur la relation de cause à effet est vieux comme le monde. Cette interrogation concerne les philosophes, les chercheurs et, au bout du compte les théologiens car derrière l’ultime réponse au « pourquoi », on peut y placer Dieu. Pour l’heure nous nous contenterons de la recherche et plus précisément de la recherche en santé.
Le mot « recherche » s’est substitué à celui de « découverte ». La naïveté d’un enfant est adaptée à ce dernier terme mais ne l’est plus face aux processus d’investigation qui soutiennent la curiosité scientifique. Par exemple, lorsque nous utilisons un nouveau médicament ou une nouvelle technique chirurgicale pour traiter un malade, nous voulons nous assurer que l’éventuelle amélioration susceptible de survenir après traitement provient bien du traitement lui-même et non du hasard ou d’une influence extérieure à la thérapeutique. Beaucoup, intuitivement, répondront qu’il suffit de donner le médicament à un groupe de malade et d’observer si les malades guérissent. Intuitivement également, on comprendra que si l’on place un glaçon dans une tasse de thé chaud, ce n’est pas à cause du thé qu’il va disparaître. Cette intuition repose cependant sur l’observation : c’est parce que nous observons qu’un glaçon fond à la chaleur, même en absence de thé, que nous en déduisions que le thé en lui-même ne peut être responsable de sa disparition. L’intuition est ce que le philosophe Pascal appelait l’esprit de finesse. Cette intuition est nécessaire à la recherche de la vérité mais non suffisante. Si notre intuition s’applique généralement pour les actions de la vie courante face à des situations simples, elle s’avère souvent insuffisante si nous nous interrogeons sur ce qui aurait pu se passer si nous avions agi différemment. Poser la question de savoir si les malades guérissent vraiment grâce au traitement, c’est-à-dire si le traitement est efficace, n’est donc pas superfétatoire. Il va falloir recourir à ce que Pascal appelait l’esprit de géométrie, mettre un peu de méthode au sens où Descartes l’entendait. L’un ne va pas sans l’autre, esprit de géométrie et esprit de finesse sont à la base de la démarche du chercheur, particulièrement dans le domaine de la santé.
L’inférence causale ou relation de cause à effet pose donc la question générique suivante : est-ce que la cause est bien responsable de l’effet ? La complexité de la réponse est à l’aune de la simplicité du mot qui la suscite (cf plus haut mon petit-fils…). La causalité implique de mettre en forme la bonne question, ce qui demande une réflexion. Le langage façonne nos idées : pour bien répondre à une question, il faut d’abord avoir correctement formulée cette dernière. On le sait particulièrement aujourd’hui avec l’intelligence artificielle qui se nourrit de « prompts », c’est-à-dire d’instructions écrites ou vocales qui doivent être intelligibles pour la machine et demandent à être maîtrisés1. Ces questions en recherche évoluent au fil de nos connaissances et deviennent donc de plus en plus sophistiquées au risque de noyer la réponse dans un océan de variables où il est difficile d’identifier la cause sans s’aider d’une ou plusieurs méthodes. N’oublions jamais qu’en médecine et en odontologie en particulier, la prise de décision doit reposer sur une preuve scientifique rigoureuse. Cette prise de décision dépend de la relation causale et non des chiffres sur lesquelles elle s’appuie qui sont le plus souvent l’arbre derrière lequel se cache la forêt. C’est la puissance de cette preuve et les méandres qui accompagnent sa démonstration qui intéressent cet article. Car si le traitement n’est pas la cause de la guérison, alors, pourquoi l’appliquer ? Voici donc quelques pistes pour comprendre l’inférence causale en santé orale.
La recherche de la causalité est un processus clé tant en santé publique qu’en pratique quotidienne, et les stratégies en politique de santé ne peuvent en faire l’impasse. Dans l’univers de la causalité, tout n’est pas aussi simple que la causalité directe. Les bactéries de l’espèce Vibrio cholerae cause le choléra mais la figure 1 indique que la bactérie pathogène Porphyromonas gingivalis n’est pas suffisante pour causer la parodontite (Bouchard et al. 2017).
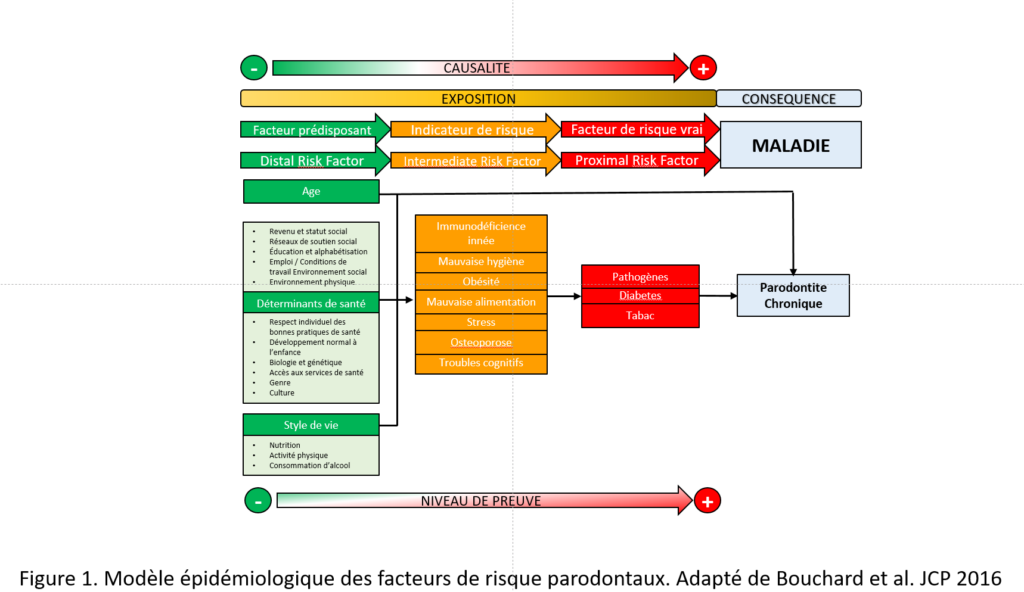
Ainsi, la participation de différentes variables concomitantes à l’effet rend la recherche de la causalité difficile, particulièrement en santé orale, comme le montre également la figure 2 qui tente de résumer l’influences de l’enfant, de la famille et de la communauté sur les résultats en santé bucco-dentaire chez l’enfant (Fisher-Owens et al. 2007).

Nous savons tous que la corrélation n’est pas la causalité. Ce n’est pas parce que deux variables sont associées que l’une est la cause de l’autre. Comme l’écrit Judea Pearl, ce n’est pas parce le coq chante que le soleil se lève, même si le chant du coq est associé au lever du soleil (Pearl et Mackenzie 2018). Il est également peu probable que certains critères ajoutés à la corrélation soient en mesure de déterminer la relation causale. Pour exemple, la classique approche de la causalité par Bradford Hill semble aujourd’hui dépassée (Hill 1965). Pour Hill, la « qualité » de l’association repose sur les critères suivant : la force, la stabilité, la spécificité, la temporalité, la plausibilité et la cohérence du lien. Un bon gradient biologique (effet-dose), des preuves expérimentales et une analogie avec d’autres association viennent compléter ces critères. En résumé, les critères de Hill constituaient jusqu’à lors un panel de caractéristiques qui, prisent dans leur ensemble, permettaient de suggérer la causalité dans le cadre d’études observationnelles. A la lumière de ce que nous savons aujourd’hui de la relation causale, parmi ces 9 critères, seule la temporalité, c’est-à-dire la survenue de la cause avant l’effet, est nécessaire mais non suffisante pour affirmer la causalité2. Ainsi, ce n’est pas en ajoutant des critères spécifiques à une association que celle-ci génère une relation de causalité. Alors, comment faire ?
Nous devons pour cela mettre en place une structure de raisonnement, c’est-à-dire des modèles permettant l’inférence causale, des moyens d’identifier l’effet d’une variable au sein d’un système complexe. Par exemple, pour faire référence aux figure 1 et 2, l’effet de l’obésité sur l’incidence de la parodontite ou l’effet de la variable « dental insurance » sur la santé orale. Les deux modèles les plus utilisé sont le modèle causal de Neyman-Rubin ou modèle à résultats potentiels reposant sur l’analyse contrefactuelle (Rubin 1990) et le diagramme causal développé par Judea Pearl (Pearl, Gylmour, Jewel 2016) que nous allons développer ensuite.
Le modèle causal de Neyman-Rubin
Le raisonnement contrefactuel consiste à imaginer ce que serait un effet si on en modifiait le résultat. Que se serait-il passé si… ? Que se serait-il passé si Napoléon avait gagné à Waterloo ? S’il avait perdu à Austerlitz ? Les méthodes contrefactuelles comprennent les essais cliniques randomisés (ECR) et certaines études observationnelles. Le modèle causal de Neyman-Rubin repose sur le fait que si nous voulons comparer par exemple l’effet du brossage chez un individu, il faudrait le comparer en même temps à l’absence de brossage chez le même individu, ce qui n’est évidemment pas possible. Que se serait-il passé si les sujets étudiés ne s’étaient pas brossé les dents ? Ainsi, le problème fondamental de l’inférence causale est que nous ne pouvons observer en même temps qu’un seul résultat et, comme l’autre est absent, la causalité individuelle ne peut être identifiée. Afin de résoudre ce problème, nous pouvons comparer des échantillons de population et estimer l’effet causal moyen entre les échantillons. L’essai clinique randomisé (ECR) est adapté puisque la randomisation permet (1) l’équivalence des groupes et (2) la comparaison des moyennes de chaque groupe nous donne la possibilité d’estimer l’effet causal moyen.
La recherche expérimentale (ECR) se situe au-dessus de la recherche observationnelle en termes d’évidence causale car elle ne rend pas seulement compte de ce qui est mais elle modifie ce qui est pour rendre compte de ce qui se passerait si les événements ne se déroulaient pas comme on les observe. Par exemple, une question que peut se poser l’industrie est : est-il préférable en termes de bénéfice de doubler le prix du dentifrice ou de doubler le diamètre de l’orifice du tube ? L’intuition tend à nous faire pencher vers l’augmentation du diamètre, mais il n’est pas certain que ce soit la bonne solution tant que nous n’en avons pas testé l’option. Méfions-nous de l’esprit de finesse sans l’avoir soumis à l’esprit de géométrie. Le cas d’école est celui de l’étude CAST (Cardiac Arrhythmia Suppression Trial), un ECR multicentrique puissant en double aveugle qui testa l’hypothèse que la prise d’antiarythmique après infarctus du myocarde réduisait le taux de mortalité, l’infarctus du myocarde entrainant le plus souvent des troubles du rythme. Contrairement à ce que la logique inspirait, le taux de mortalité était plus important dans le groupe qui prenait des antiarythmiques que dans le groupe contrôle qui n’en prenait pas. Ainsi, cette étude provoqua un changement de paradigme et la prise systématique d’arythmiques post-infarctus fut arrêté.
Cependant, dans de nombreux cas les ECR ne sont pas possibles en raison de leur coût élevé, leur longue durée de suivi ou pour des raisons éthiques. Evaluer l’effet causal du tabac à l’aide d’un ECR sur l’état parodontal nécessiterait le suivi à plus ou moins long terme d’un échantillon fumeur versus un non-fumeur en randomisant, les sujets c’est-à-dire tirant au hasard leur attribution à un groupe. On comprend facilement que cela n’a éthiquement pas de sens. Une simple recherche non filtrée sur PubMed croisant «periodontitis AND dental plaque » récolte 15 982 articles ; tandis qu’en utilisant le filtre « clinical trial » ce nombre se réduit à 2 990, soit 18,7%% des articles (recherche au 10/09/2024). C’est dire que la complexité de l’ECR fait fuir bon nombre d’investigateurs. D’autre part, les facteurs d’inclusion, de non-inclusion et d’exclusion des sujets participant à une ECR sont souvent si rigoureux que ces derniers ne sont souvent pas représentatifs du profil des individus fréquentant les cabinets dentaires.3
Ainsi, la plupart des études sont observationnelles4. C’est la raison pour laquelle les critères de Bradford Hill se sont avéré longtemps utiles pour tenter d’approcher la causalité. Pouvons-nous aujourd’hui essayer d’explorer la causalité en exploitant les résultats des études observationnelles ? Le modèle causal de Neyman-Rubin peut apporter une réponse positive qui repose, comme souvent en statistiques, sur un certain nombre de conditions. La première condition est que l’observation d’un résultat individuel ne doit pas être affectée par l’attribution du traitement aux autres individus (hypothèse STUVA5). Il ne doit pas y avoir d’interférence entre les individus. Si on étudie l’efficacité d’une nouvelle technique de brossage A versus, par exemple, une technique de référence B, la qualité du brossage d’un individu utilisant la technique A ne doit pas être affecté par le fait qu’un autre individu soit affecté au groupe utilisant la technique de référence B. On ne peut par exemple attribuer les brossages A et B dans une même famille, le sujet utilisant la nouvelle technique de brossage peut avoir un effet d’entraînement sur l’autre membre de la famille utilisant la technique de référence. Le sujet utilisant la nouvelle technique A se brossera sans doute mieux les dents que d’habitude (effet nouveauté) et pourra influencer le comportement habituel du sujet utilisant la technique de référence B. Si l’hypothèse STUVA n’est pas respectée, on peut essayer de comparer non plus des individus mais des institutions (hôpitaux si l’étude est hospitalière) ou des quartiers par exemple, sous réserve encore que l’hypothèse STUVA soit respectée dans ces nouvelles conditions.
Il ne peut y avoir d’autre part, différentes versions du traitement étudié. Dans notre exemple, un sujet peut être amené à modifier la nouvelle technique de brossage parce cette modification lui procure l’impression d’être plus efficace. L’étude de l’efficacité d’une technique chirurgicale est particulièrement sensible à cette première condition. Un chirurgien peut par exemple, à la lumière de l’expérience des premiers cas qu’il opère, modifier légèrement la technique évaluée pour le bien du malade et violer ainsi cette hypothèse. C’est la raison pour laquelle, les études pilotes (études de faisabilité) sont souvent utiles, particulièrement en chirurgie, à condition bien entendu qu’elles soient suivies d’ECR, ce qui n’est hélas pas toujours le cas. La seconde condition est que tous les facteurs de confusion, susceptible d’agir à la fois sur la variable dépendantes (celle pour laquelle on recherche la causalité) et la variable dite « explicative » (celle qui est susceptible d’expliquer la causalité) doivent être identifiés, mesurés et maîtrisés. Enfin, la troisième condition est que la probabilité d’attribution d’un individu à un groupe doit être la même pour chaque individu.
Si toutes ces conditions sont remplies, alors nous pouvons envisager l’inférence causale. Prenons comme exemple l’étude de l’efficacité d’une technique de brossage spécifique chez l’adulte handicapé. Nous sélectionnerons d’abords l’échantillon cible (des adultes issus d’une population homogène d’handicapés6) et comparerons 2 groupes issus de l’échantillon cible, l’un utilisant la technique de brossage étudiée et l’autre utilisant son brossage habituel. Nous disposons alors de 3 échantillons : (1) l’échantillon cible regroupant les 2 échantillons suivant, (2) l’échantillon avec brossage spécifique, (3) l’échantillon sans brossage spécifique. Il est possible alors de quantifier l’effet moyen du traitement dans chacun de ces trois échantillons. Selon le modèle causal de Neyman-Rubin, la question causale associée à l’échantillon cible est : comment les résultats auraient été modifié si l’ensemble de l’échantillon avait pratiqué le brossage spécifique ou le brossage habituel ? La question causale concernant l’échantillon à brossage spécifique est : comment les résultats de ce groupe auraient été modifié si le brossage spécifique avait été interrompu ? Enfin, dans l’échantillon brossage habituel, la question causale est : comment les résultats auraient été modifié si le brossage spécifique avait été pratiqué ? A chaque question correspond un design d’étude différent. Rappelons que le raisonnement contrefactuel consiste à imaginer ce que serait un effet si on en modifiait la cause.
Nous pouvons alors définir différents types de causes en introduisant un nouveau mot : l’estimand. L’estimand est une notion initialement statistique introduite au niveau réglementaire en 2019 [new addendum to the ICH E9 (R1) guidelines]7 pour l’essai thérapeutique d’enregistrement des médicaments. C’est un canevas qui permet une description détaillée et quantifiable de l’effet du traitement et d’identifier à l’avance et d’évaluer les événements intercurrents susceptibles d’interférer avec les données observées. C’est en fait la définition claire de ce que l’on veut mesurer à l’aide d’un estimateur pour obtenir au final l’estimation. La différence entre l’estimand et l’estimateur est que l’estimand est fonction de résultats potentiels c’est-à-dire la probabilité d’obtenir ces résultats, alors que l’estimateur repose sur des données observées. L’estimateur est une estimation numérique de l’estimand. L’estimand permet une meilleure anticipation de la gestion des événements non désirés lors d’une étude clinique. Cette étape est située entre l’objectif de l’étude et son design. L’estimand comprend 5 attributs : les traitements (nouvel anesthésique vs anesthésique de référence, correspondant à l’ITT8), la population (adultes, enfants, etc…), le critère de jugement (rapidité d’action par exemple), la mesure statistique de ce dernier (différence des moyennes, des changement, etc…) et gestion des événements intercurrents (abandons, changement d’anesthésique, erreur dans le protocole, etc…). Ces attributs sont discutés durant la phase de préparation de l’essai clinique avec une attention particulière pour les événements intercurrents dont la présence rend parfois délicate l’interprétation des résultats. Chaque type d’événement intercurrent est ici clairement traité avant le début de l’étude. Cette étape conceptuelle a l’avantage de formaliser une méthode que les chercheurs utilisent déjà depuis longtemps lors de la mise ne place d’un essai clinique, apportant plus de transparence dans la méthodologie.
Le diagramme causal
Comme nous l’avons souligné, les études expérimentales (ECR) ne sont pas toujours possibles. Ainsi, pouvons-nous tenter d’explorer la causalité en utilisant les données d’études non-expérimentales (observationnelles) ? Le diagramme causal développé par Judea Pearl permet une simplification de l’inférence causale reposant sur la célèbre maxime napoléonienne : un bon croquis vaut mieux qu’un long discours. Nous l’avons utilisé récemment à deux reprises, (1) pour illustrer les options causales entre l’athérosclérose et la parodontite (Carra MC et al. 2023) et (2) pour souligner l’incertitude de la relation causale entre trouble du sommeil et mauvaise santé parodontale (Carra MC, Balagny P, Bouchard P 2024). Prenons le second exemple concernant l’association entre troubles du sommeil et santé parodontale. La question est : les troubles du sommeil sont-ils une des causes des parodontites ? On sait qu’un mauvais état de santé générale est associé à la fois aux troubles du sommeil (l’exposition) et à la parodontite (l’évènement). C’est le cas de l’obésité par exemple mais nous prendrons ici un aspect plus global en parlant d’état général. Quel est le rôle d’un mauvais état général dans la relation causale entre les troubles du sommeil (variable dépendante) et la parodontite (variable explicative) ?
Les diagrammes de la figure 3 illustrent les différentes options. Ces diagrammes sont appelé DAG (Direct Acyclic Graph), direct car la cause entraine l’effet et acyclique car la cause précédant l’effet, il n’est pas possible de revenir en arrière et de former un cycle. Chaque flèche représente un effet causal. La flèche horizontale représente un chemin causal direct. Les figures A, B et C correspondent aux différents modèles susceptibles d’expliquer l’association entre la parodontite et les troubles du sommeil, en tenant compte du rôle du mauvais état général en tant que facteur de confusion (A), collisionneur (B) ou médiateur (C).

- Dans le cas A, le mauvais état général est à la fois cause de troubles du sommeil et de la parodontite. C’est un facteur de confusion sur lequel il faudra méticuleusement identifier car cette identification est le problème central de l’inférence causale. Nous devons donc contrôler, c’est-à-dire bloquer, ces facteurs en les identifiant, le plus souvent à l’aide d’une étude rigoureuse de la littérature. Différentes méthodes d’ajustement s’offrent à nous pour rendre constant ces facteurs, telles que l’analyse de régression, la pondération, la stratification, l’appariement, la standardisation, le score de propension, etc… Ces méthodes dépendent des données à analyser : régression logistique pour les événements dichotomiques, linéaire pour des événements quantitatifs continus, de Cox pour des événements dépendants du temps. Elles ne font pas l’objet de cet article et ne sont pas abordés ici. Il suffit de comprendre que ces méthodes permettent d’étudier la causalité entre 2 variables en tenant compte de l’effets de variables extérieures susceptibles de polluer la relation causale.
- Dans le cas B, le mauvais état général est un collisionneur (collider en anglais). A savoir que le mauvais état général est un effet commun aux troubles du sommeil et à la parodontite. Il est la conséquence d’un biais de sélection. Il n’y a évidemment pas lieu d’ajuster sur un collisionneur. On n’ajuste pas sur un biais.
- Enfin, dans le cas C, le mauvais état général transmet l’effet du trouble du sommeil à la parodontite, c’est un médiateur. Le contrôler serait surajuster et la relation causale serait bloquée.
Il est donc capital d’identifier les variables susceptibles d’influer sur la relation causale selon qu’elles constituent une cause commune (facteur de confusion sur lequel ajuster), un effet commun (collisionneur) ou agissent comme médiateur. En effet, se tromper sur la nature du rôle d’une variable extérieure entrainerait soit un défaut d’ajustement (facteur de confusion non identifié) soit un ajustement erroné (ajustement sur un biais de sélection), soit un surajustement (ajustement sur un médiateur faussement identifié comme facteur de confusion).
L’avantage majeur des DAG est le complément visuel qu’ils apportent pour simplifier la relation causale. Il faut cependant se méfier des DAG simplifiés. L’exemple de la consommation de sucre témoigne de l’utilisation erronée qui peut en être faite. La consommation excessive de sucre entraine une inflammation qui peut être interprétée comme un médiateur. Ce n’est pas parce que les maladies parodontales sont des maladies inflammatoires que la consommation de sucre est la cause des maladies parodontales. Ou alors, la consommation de sucre est la cause de la maladie de Crohn, de la polyarthrite rhumatoïde, de la sclérose en plaque, etc… Utiliser une variable distale comme levier de causalité potentielle fait prendre le risque d’effacer l’importance de variables proximales dans la relation causale (Pearl J, Glymour, M, Jewell, NP 2016). Les chemins de la causalité n’excluent pas le bon sens.
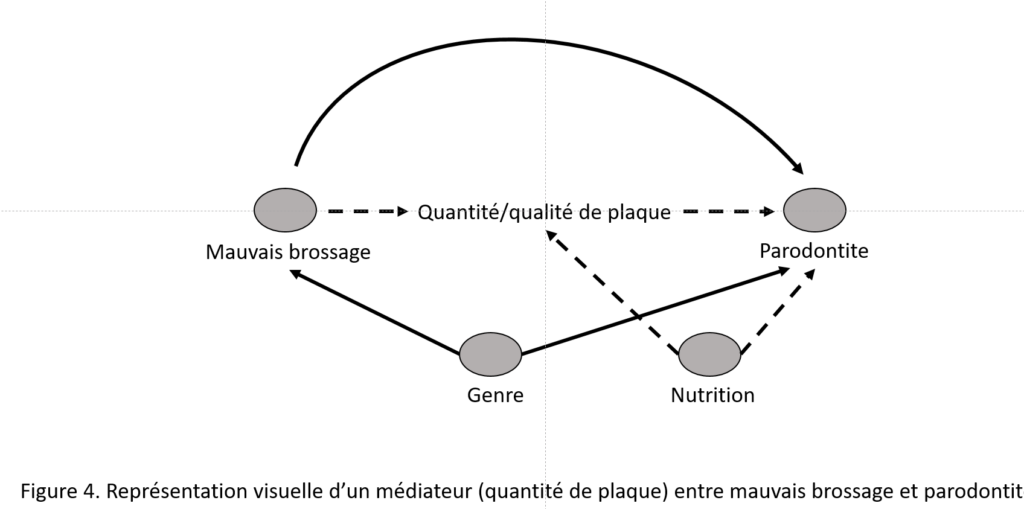
Le plus souvent, les DAG sont très complexes en raison des multiples facteurs pouvant influencer la causalité et nous ne pouvons ici entrer dans le détail de leur utilisation9. L’exemple très simplifié du rôle d’un mauvais brossage en tant que cause de la parodontite illustre l’intérêt des DAG (Figure 3). On sait que le genre est un facteur de confusion : les hommes se brossent moins souvent les dents que les femmes et la prévalence de la parodontite est plus élevée que chez les femmes.
On connait également l’influence de la nutrition sur la quantité/qualité de plaque et sur la parodontite. Or la quantité/qualité de plaque est un médiateur entre le mauvais brossage et la parodontite. On ajustera donc sur le genre (facteur de confusion) et non sur la nutrition puisqu’elle n’intervient pas sur la relation causale brossage/parodontite mais sur la relation causale entre le médiateur (plaque) et la parodontite. Le DAG de la figure 4, illustre bien comment cette approche visuelle peut simplifier la relation causale qui s’analyse à partir des flèches pleines et non plus sur la totalité des flèches dont certaines ne sont pas à prendre en compte (flèches pointillées).
Enfin, pour identifier la relation causale entre deux variables qui ne peuvent donner lieu à un ECR, on peut utiliser une variable de substitution ou « proxy» appelée variable instrumentale. Par exemple pour savoir si la consommation de sucre est la cause de la carie dentaire on peut utiliser une variable instrumentale composite qui allie les données de production et d’importation aux données de consommation. Le diagramme de la figure 5 illustre cet exemple et l’intérêt du DAG pour éliminer le facteur de confusion qu’est le statut socio-économique.

Le DAG ici nous fait comprendre qu’il n’y a pas lieu d’ajuster sur ce facteur si nous utilisons les données nationales de consommation de sucre comme variable instrumentale puisque le statut socio-économique n’a pas de relation causale avec les données nationales (exemple fictif qui demande à être vérifié10…). Pour mémoire, cette approche est celle utilisée dans la randomisation mendélienne qui utilise la variation génétique11 associée à l’exposition potentielle comme variable instrumentale. La faible puissance des études génétiques en odontologie rend encore aujourd’hui réservée l’approche de la causalité par la randomisation mendélienne.
En conclusion, si l’ECR reste et demeure la méthode la moins biaisée pour évaluer une relation causale, l’ECR appartient au domaine de la recherche et les résultats ne peuvent pas toujours correspondre à ceux obtenus dans des conditions cliniques habituelle. L’ECR isole le plus souvent un seul facteur alors que la décision clinique est holistique. Des outils statistiques ont vu le jour pour tenter d’estimer la causalité à l’aide d’études observationnelles. Elles se rapprochent des conditions expérimentales des ECR. Néanmoins, chaque fois que nous nous intéresserons à des études observationnelles, nous parlerons d’association et non de cause, ce dernier terme étant réservé pour l’instant aux ECR. Il convient aussi de ne pas mépriser les études observationnelles car ce sont elles qui à l’heure actuelle, en majorité, guident nos décisions cliniques. De plus, l’observation minutieuse d’un phénomène est indispensable à l’étude de sa causalité. La difficulté aujourd’hui est que de plus en plus d’études interventionnelles mettent en évidence l’impact de nouvelles variables sur la causalité, rendant ainsi celle-ci de plus en plus difficile à mettre en évidence, en raison de la compétition qu’elles entretiennent entre elles. Enfin, les maladies orales sont multifactorielles. Si la plaque était responsable de tout, ce serait évidemment trop simple.
Références
- Bouchard P, Carra MC, Boillot A, Mora F, Rangé H. Risk factors in periodontology: a conceptual framework. J Clin Periodontol. 2017 Feb;44(2):125-131. doi: 10.1111/jcpe.12650. Epub 2016 Dec 16. PMID: 27862138.
- Fisher-Owens SA, Gansky SA, Platt LJ, Weintraub JA, Soobader MJ, Bramlett MD, Newacheck PW. Influences on children’s oral health: a conceptual model. Pediatrics. 2007 Sep;120(3):e510-20. doi: 10.1542/peds.2006-3084. PMID: 17766495.
- Pearl J, Mackenzie D. The Book of Why: The New Science of Cause and Effect. 432p. Penguin Science 2018.
- Hill AB. The environment and disease: association or causation? Proc R Soc Med. 1965 May;58(5):295-300. PMID: 14283879; PMCID: PMC1898525.
- Rubin, D. B. (1990). Neyman (1923) and causal inference in experiments and observational studies. Statistical Science, 5, 472–480.
- Pearl, J., Glymour, M., & Jewell, N. P. (2016). Causal inference in statistics: A primer. Wiley.
- Carra MC, Rangé H, Caligiuri G, Bouchard P. Periodontitis and atherosclerotic cardiovascular disease: A critical appraisal. Periodontol 2000. 2023 Nov 23. doi: 10.1111/prd.12528. Epub ahead of print. PMID: 37997210.
- Carra MC, Balagny P, Bouchard P. Sleep and periodontal health. Periodontol 2000. 2024 Sep 4. doi: 10.1111/prd.12611. Epub ahead of print. PMID: 39233377.
Notes
1 Il existe aujourd’hui ne nombreux sites pour apprendre à rédiger des prompts, en voici deux : en français : https://datascientest.com/prompt-tout-savoir; en anglais : https://huit.harvard.edu/news/ai-prompts.
2 Ce problème de temporalité est particulièrement marquant lorsqu’on étudie la causalité entre parodontite et athérosclérose. Il n’y a aucune preuve que la parodontite précède la formation des plaques d’athérome. La maladie athéromateuse débute ente 20 et 40 ans (https://www.fedecardio.org/je-m-informe/l-atherosclerose/), âge où la prévalence des parodontites est faible.
3 Ceci a donné lieu à l’avènement d’essais cliniques dit « pragmatiques », utilisant souvent le Big data et reposant sur de larges bases de données (assurances, institutions, etc…). Moins rigoureux mais plus accessible à la compréhension et surtout plus proches de la réalité clinique, ces essais ne peuvent aujourd’hui donner lieu à une inférence causale. Il y a cependant lieu de penser que l’avènement de l’intelligence artificielle permettra de faire le tri parmi le flot de variables influençant la relation causale.
4 Nous devons hélas nous en contenter, en particulier en santé orale car les ECR coûtent chers et les budgets mis à la disposition de cette recherche sont souvent en-deçà de ceux alloués aux autres disciplines médicale.
5 Stable Unit Treatment Value Assumption.
6 Homogène veut dire que les critères d’admissibilité à l’essai clinique sont remplis par tous les participants.
7 https://www.ema.europa.eu/en/documents/scientific-guideline/ich-e9-r1-addendum-estimands-sensitivity-analysis-clinical-trials-guideline-statistical-principles_en.pdf
8 Intention To Treat : les résultats reposent sur l’analyse de tous les patients randomisés, y compris les écarts au protocole (abandons, non suivi du protocole initial, etc…). Par opposition l’analyse « per protocol » n’inclue que les patients ayant achevé l’étude dans les conditions du protocole initial.
9 Pour complément d’information, le lecteur peut visiter le site du dagitty tool (https://wwwdagitty.net/).
10 Cet exemple n’est sans doute pas parfait car la variable socio-économique est ubiquitaire en santé.
11 Habituellement le polymorphisme nucléotidique (SNP).
